POINTS PRINCIPAUX
-
Très peu de sports utilisent uniquement l'endurance ou la force. En dehors de la course de longue distance sur une surface plate et l'haltérophilie, pratiquement tous les sports requièrent à la fois de l'endurance et de la force.
-
L'endurance et la force peuvent être développées simultanément jusqu'à un certain point. Cependant, à mesure qu'augmentent la fréquence et l'intensité de l'entraînement d'endurance, le développement ou le maintien de la masse et de la force musculaires sont ralentis. Cette interaction entre l'endurance et la force est appelée l'effet de l'entraînement concomitant.
-
L'augmentation de la force et de la masse musculaire nécessite l'activation de cible mammalienne de la rapamycine (mTOR). La molécule de signalisation mTOR est activée au niveau maximal lors du soulèvement de poids lourds jusqu'à l'épuisement et de la consommation de protéines riches en leucine.
-
Les adaptations d'endurance se produisent lorsque le stress métabolique est à son plus haut niveau (lorsque l'approvisionnement en énergie est faible et la demande en énergie est élevée). Le stress métabolique active la protéine kinase activée par l'anédosine-monophosphate (AMPK) et la déacétylase sirutine 1 (SIRT1) dépendante de la nicotinamide adénine dinucléotide (NAD).
-
L'effet de l'entraînement concomitant peut être expliqué au niveau moléculaire, en partie par le fait que le stress métabolique (augmentation des activités AMPK et SIRT1) peut inhiber l'activation de la mTOR et l'hypertrophie musculaire.
-
En comprenant : a) l'importance de la mTOR dans le développement de la masse et de la force musculaire; b) la durée de l'activation de la mTOR; et c) le rôle de l'alimentation dans l'activation de la mTOR/AMPK/SIRT1, un simple plan d'entraînement et d'alimentation peut être développé pour maximiser la force et l'endurance.
INTRODUCTION À LA SCIENCE DE L'ENTRAÎNEMENT CONCOMITANT
Robert Hickson était un haltérophile quand il commença ses travaux de recherche postdoctorale dans le laboratoire du professeur John Holloszy, le « père de la recherche sur l'exercice d'endurance ». Pour faire bonne impression, Dr. Hickson accompagnait son nouveau patron dans ses courses d'après-midi, mais découvrit rapidement une diminution de sa masse et de sa force musculaires malgré l'entraînement de force qu'il effectuait avec la même fréquence et la même intensité. Lorsque Hickson fit part au professeur Holloszy de son problème, celui-ci lui dit : « Cela devrait faire l'objet de votre première étude lorsque vous aurez votre propre laboratoire. » Chose promise, chose due, la première étude effectuée par Hickson dans son nouveau laboratoire à l'Université de l'Illinois à Chicago fut son étude majeure sur l'entraînement concomitant.
Publiée en 1980, l'étude classique de Hickson portait sur trois groupes de sujets : le groupe 1 a effectué un entraînement de force seulement; le groupe 2 a effectué un entraînement d'endurance seulement; le groupe 3 a effectué un entraînement de force et d'endurance. L'entraînement de force a été effectué 5 jours par semaine pendant une durée de 10 semaines et était exclusivement conçu pour augmenter la force des jambes. Fidèle à sa formation d'haltérophile, Hickson a soumis ses sujets à tous les exercices avec autant de poids que possible. L'entraînement d'endurance a été effectué 6 jours par semaine pendant une période de 10 semaines et était composé de 3 jours de cyclisme et de 3 jours de course. L'exercice de cyclisme était composé d'intervalles de 5 minutes à une consommation maximale de l'oxygène (VO2max), tandis que les consignes pour les jours de course étaient de « courir aussi vite que possible » pendant 30 minutes par jour la première semaine, 35 minutes par jour la deuxième semaine et 40 minutes par jour pendant le reste de l'étude. Le groupe de l'entraînement concomitant a effectué à la fois des protocoles d'entraînement de force et d'endurance dans un ordre non standardisé, avec des intervalles de repos de 15 minutes et 2 heures.
À la fin du programme d'entraînement de 10 semaines, la VO2max a été déterminée sur vélo et tapis roulant. Le groupe d'entraînement de force a montré une amélioration de 4 % de VO2max sur vélo, sans changement dans les mesures maximales sur tapis roulant. En revanche, les groupes d'entraînement d'endurance et d'entraînement concomitant ont montré une augmentation de VO2max de 17 % sur tapis roulant et d'environ 20 % sur vélo. Cela indiquant que l'entraînement de force n'affectait pas négativement les adaptations ou la performance. Mais il convient de noter que le groupe d'entraînement concomitant n'a pas enregistré d'augmentation de poids pendant la période d'entraînement à la suite de l'entraînement de force. Si cela avait été le cas, nous nous serions attendus à une augmentation du coût énergétique de l'exercice (Roberts et al., 1998). L'augmentation du coût énergétique sur une distance donnée (moins d'économie) réduirait la performance à l'endurance, notamment dans la course où il faudrait soutenir et faire avancer cette masse supplémentaire.
Dans les groupes d'entraînement de force et d'entraînement concomitant, la force moyenne a augmenté au même taux pendant les 6 à 7 premières semaines de l'entraînement (Figure 1). La force a continué d'augmenter pendant la période d'entraînement complète de 10 semaines dans le groupe d'entraînement de force. En revanche, dans le groupe d'entraînement concomitant, la force s'est stabilisée entre la 7e et la 8e semaine et a diminué de façon surprenante pendant la 9e et la 10e semaines d'entraînement. Cela indique que l'exercice d'endurance à haute intensité et à une fréquence suffisante peut inhiber les adaptations de la force à long terme.
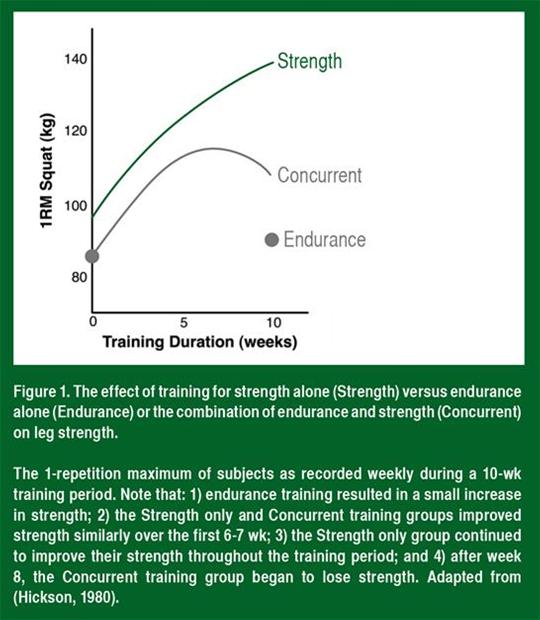
Lorsque d'autres chercheurs ont repris la même fréquence et la même intensité utilisées par Hickson dans son étude, ils ont découvert des diminutions similaires et matière de développement de la force et une altération de l'hypertrophie des fibres musculaires (Kraemer et al., 1995; Wilson et al., 2012). Par exemple, Kraemer et ses collègues (1995) ont démontré que la course et l'entraînement de force à haute intensité pendant 4 jours par semaine provoquent des gains de puissance minimes et une altération de l'hypertrophie des fibres musculaires par comparaison avec l'entraînement de force. Celui-ci produit une hypertrophie d'environ 28 %, tandis que l'entraînement concomitant produit une hypertrophie de seulement 16 % environ. Cela indique que l'entraînement d'endurance concomitant a altéré non seulement la force, mais également l'hypertrophie des muscles.
Toutes les études sur l'exercice concomitant ne démontrent pas que l'endurance bloque les adaptations de la force. En fait, les études où la fréquence ou l'intensité de l'entraînement est réduite ne constatent aucun effet d'interférence. Par exemple, dans deux études distinctes, McCarthy et ses collègues ont démontré que des séances de cyclismes de 50 minutes 3 jours par semaine à 70 % VO2max ne suffisent pas à altérer la force (1995) ou l'hypertrophie (2002) comme résultat de l'entraînement de force concomitant. Ces données suggèrent que la force et l'endurance peuvent augmenter ensemble jusqu'à un certain point. Cependant, lorsque la fréquence augmente à plus de 4 jours par semaine ou que l'intensité de l'exercice d'endurance dépasse 80 % de VO2max, l'exercice d'endurance ralentit ou limite l'augmentation de la masse et de la force musculaires qui se produit avec l'entraînement de force. Cela a été bien illustré dans une méta-analyse récente qui a démontré que l'importance des effets de l'entraînement de force sur l'hypertrophie et la force est de 1,22 et 1,71, respectivement (Wilson et al., 2012). Les chiffres correspondants de l'entraînement concomitant sont de 0,8 et 1,28, ce qui indique que, selon une vaste étude, l'exercice d'endurance altère la taille des muscles et les adaptations de la force.
MÉCANISME MOLÉCULAIRE DE L'EFFET DE L'ENTRAÎNEMENT CONCOMITANT
L'augmentation de la force est l'effet combiné des améliorations dans l'activation neurale, de la taille des fibres musculaires et de la rigidité des tissus conjonctifs. Par conséquent, l'exercice d'endurance concomitant pourrait réduire les adaptations d'une partie ou de la totalité de ces paramètres physiologiques. Il ne semble pas y avoir de diminution de l'adaptation neurale (apprentissage) puisque, au début de l'entraînement où l'adaptation neurale est à son plus haut niveau (4e, 6e et 8e semaine; voir Figure 1), la force est similaire dans les groupes d'entraînement de force et d'entraînement concomitant (Hickson, 1980; Kraemer et al., 1995). À ce jour, personne n'a mesuré l'effet de l'entraînement concomitant sur la rigidité des tissus conjonctifs. Nous ne connaissons donc pas exactement le rôle de ces tissus dans la réaction la réduction de la force. Toutefois, comme indiqué ci-dessus, des études ont démontré que l'hypertrophie musculaire est altérée chez les personnes qui s'entraînent à haute intensité à la fois pour la force et et pour l'endurance, par comparaison aux personnes qui s'entraînent uniquement avec des exercices de force, ce qui s'accorde bien avec la réaction à la réduction de la force (Kraemer et al., 1995; Wilson et al., 2012). L'effet principal de l'exercice d'endurance semble donc être une réduction de l'hypertrophie musculaire induite par l'exercice de résistance.
Des articles précédents de Sports Science Exchange (Baar, 2013; Baar, 2014) ont abordé les événements moléculaires qui se traduisent par une hypertrophie musculaire et une augmentation de la capacité liée à l'endurance. En bref, ces études ont démontré que pour l'hypertrophie musculaire induite par l'exercice, la molécule de signalisation principale est la cible mammalienne de rapamycine (mTOR), tandis que les adaptations d'endurance sont le résultat du stress métabolique détecté par les protéines telles que les kinases calcium-calmoduline (CaMK), la protéine kinase activée par l'AMP (AMPK), la protéine kinase activée par le mitogène 38KDa (p38) et la famille des déacétylases sirutines 1 (SIRT1) dépendantes de la nicotinamide adénine dinucléotide (NAD+).
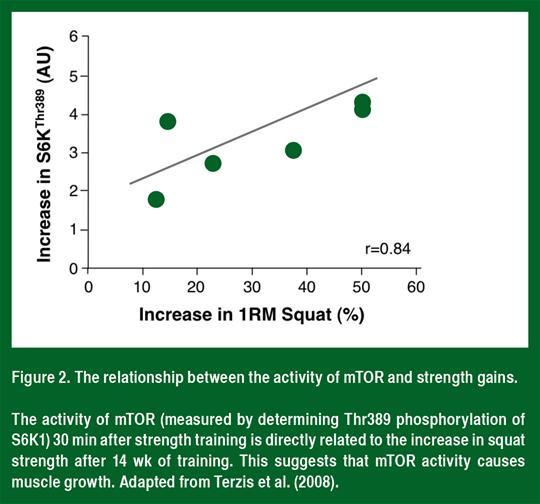
La mTOR est une protéine kinase sérine/thréonine qui contrôle le taux de synthèse des protéines. Chez les personnes et les animaux exempts de maladies étudiés à ce jour (Figure 2), l'activité mTOR (telle que déterminée par la phosphorylation de S6K1) est liée à l'hypertrophie musculaire (Baar et Esser, 1999; Terzis et al., 2008). Par ailleurs, la rapamycine inhibitrice spécifique à la mTOR bloque à la fois l'augmentation aiguë dans la synthèse des protéines après l'entraînement de force (Drummond et al., 2009) et l'hypertrophie musculaire consécutive à la charge (Goodman et al, 2011). Ces données suggèrent que l'activation de mTOR est nécessaire pour l'hypertrophie musculaire consécutive à l'entraînement de force.
L'exercice d'endurance à haute intensité permet d'activer CaMK, AMPK, p38 et SIRT1. Toutes ces protéines augmentent la quantité et/ou l'activité du coactivateur 1 des proliférateurs de peroxysomes ga (PGC-1a), qui est un facteur transcriptionnel qui augmente la masse mitochondriale et le nombre de capillaires dans les muscles. Même si toutes ces protéines sont activées par l'exercice, l'activation de l'AMPK (par l'augmentation des AMP libres) et de la SIRT1 (par l'augmentation du flux de NAD, c'est-à-dire la production de lactate) est très étroitement liée à l'entraînement à haute intensité. Il est donc très probable qu'elle bloque l'hypertrophie musculaire.
La première indication qu'un mécanisme moléculaire pourrait expliquer comment l'exercice d'endurance peut altérer l'hypertrophie dans l'entraînement de force concomitant est apparue lorsqu'il a été démontré que le stress métabolique bloque l'activité de mTOR (Inoki et al., 2003). Au cours des dernières années, il est devenu clair que le stress métabolique peut bloquer la mTOR par les moyens suivants : 1) la phosphorylation et l'activation par l'AMPK du complexe de sclérose tubéreuse (TSC2) de l'inhibiteur mTOR (Inoki et al., 2003); 2) la phosphorylation et l'inhibition par l'AMPK du piège régulateur de mTOR (Gwin et al., 2008); et 3) la prévention de localisation de la mTOR dépendante de l'AMPK dans le lysosome (Kim et al., 2013).
En prenant en considération à la fois stress/activation AMPK sur la mTOR et le fait que le stress métabolique et l'activité AMPK ont été augmentés pendant l'exercice d'endurance, les physiologistes de l'exercice ont commencé à se poser la question : « L'AMPK peut-elle limiter l'hypertrophie musculaire? » Thomson et Gordon (2005) ont été les premiers à démontrer que l'altération de la croissance musculaire survient chez les rats en cas d'augmentation de l'activité AMPK, ce qui corrobore l'hypothèse que l'AMPK intervient dans l'effet de l'entraînement concomitant. Les auteurs sont allés plus loin, en utilisant un médicament pour activer l'AMPK dans les muscles avant l'exercice de résistance et, conformément à l'hypothèse, ont bloqué l'activation de mTOR (Thomson et al., 2008). Par conséquent, l'activité AMPK élevée peut inhiber l'activation mTOR chez les animaux.
Le laboratoire de John Hawley (Figure 3) a démontré que l'activité de mTRO est inhibée chez les humains après dix sprints maximaux de 6 secondes, mais non après une séance de cyclisme de 30 minutes à une intensité modérée (Coffey et al., 2009a, b).
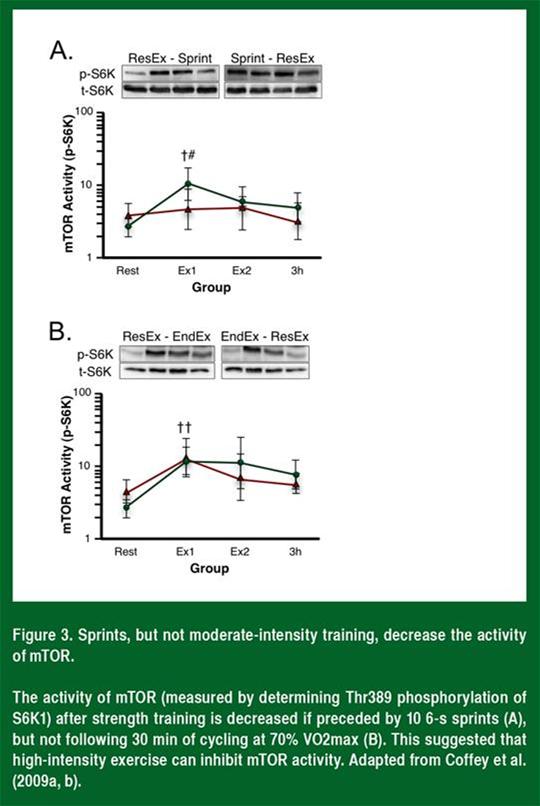
En accord avec le fait que l'intensité de l'exercice d'endurance est la clé pour comprendre l'effet d'interférence, Lundberg et al. (2012) n'ont découvert aucune inhibition de l'activation de mTOR lorsque les sujets ont effectué seulement une séance de cyclisme de 45 minutes à 70 % de VO2max, 6 heures avant d'effectuer l'exercice de résistance. Par ailleurs, Apró et ses collègues (2013) n'ont découvert aucune diminution de la signalisation de mTOR lorsque les sujets ont effectué une séance de cyclisme de 30 minutes à 70 % de VO2max, 15 minutes après avoir terminé une séance d'entraînement de résistance. Ces résultats sont complètement concordants avec les données relatives à l'entraînement qui montrent que l'effet d'interférence n'apparaît que si les sujets s'entraînent à haute fréquence et à haute intensité (Hickson, 1980; Kraemer et al., 1995).
Même si les effets de l'intensité et les données recueillies sur les animaux sont complètement cohérents avec le fait que l'AMPK intervient dans l'inhibition de l'activité de mTOR pendant l'entraînement concomitant, dans l'étude sur les intervalles de sprint de Coffey et ses collègues (2009a), l'activation de l'AMPK dans les deux groupes d'entraînement a été identique, ce qui suggère que l'AMPK pourrait ne pas expliquer l'inhibition de l'activité de mTOR. Cela indique que, même si l'exercice d'endurance à haute intensité peut inhiber la mTOR et l'hypertrophie musculaire, d'autres protéines (probablement la SIRT1) contribuent aux mécanismes moléculaires sous-jacents à l'effet de l'entraînement concomitant.
RECOMMANDATIONS SCIENTIFIQUES POUR MAXIMISER L'ENTRAÎNEMENT CONCOMITANT
À l'aide des renseignements moléculaires fournis ci-dessus, il est possible de concevoir des stratégies simples relatives à l'alimentation et à l'entraînement pour maximiser les adaptations à l'entraînement concomitant. L'objectif de ces recommandations est de maximiser l'adaptation mitochondriale dans l'exercice d'endurance et les adaptations de la masse et de la force musculaire dans l'exercice de force. Pour ce faire, il est recommandé de :
-
Les séances d'entraînement d'endurance à haute intensité devraient être effectuées en début de journée. Il convient de prévoir une période de récupération d'au moins 3 heures pour que le stress métabolique puisse retourner aux niveaux de base avant que l'exercice de résistance ne soit effectué. Cette suggestion est fondée sur le fait que l'activité AMPK augmente rapidement, puis retourne aux niveaux de base dans les 3 premières heures après l'exercice à haute intensité (Wojtaszewski et al., 2000), tandis que l'activité mTOR peut être maintenue au moins 18 heures après l'exercice de résistance (Baar et Esser, 1999).
-
Le renouvellement complet des glucides a lieu entre la séance matinale d'entraînement d'endurance à haute intensité et la séance de force de l'après-midi, puisque l'AMPK peut être activée par de faibles réserves de glycogène (McBride et al., 2009) et que la SIRT1 est activée par la restriction calorique (Schenk et al., 2011).
-
Le renouvellement complet n'est pas possible parce que le volume et l'intensité d'entraînement pendant la saison sont trop élevés, il vaudrait mieux réserver une partie des périodes hors saison (et des courtes périodes pendant la saison) exclusivement à l'augmentation de la masse et de la force musculaires, puis utiliser les consommations élevées de protéines alimentaires pour maintenir cette masse musculaire à mesure que la charge aérobique augmente au cours de la saison (Mettler et al., 2010).
-
L'exercice de résistance doit être soutenu par 0,25 g/kg de protéine riche en leucine et directement digestible tout de suite après l'entraînement, puis toutes les quatre heures. Puisque dans ce scénario l'exercice de résistance est effectué plus tard dans la journée, il devient plus important de consommer également la protéine immédiatement avant de se coucher pour maximiser la réaction synthétique au cours de la nuit (Res et al., 2012).
-
Pour améliorer la réaction d'endurance aux séances d'entraînement d'endurance à fable intensité et fournir un stimulus de force puissance, il faudrait envisager d'effectuer l'entraînement de force immédiatement après les séances d'endurance à faible intensité, sans perte de glycogène. Effectuer une séance de force immédiatement après une séance d'endurance à faible intensité produit un stimulus plus important pour l'adaptation d'endurance que la séance d'endurance à faible intensité seulement (Wang et al., 2011), et la séance à faible intensité ne bloque pas la mTOR (Apró et al., 2013; Coffey et al., 2009b; Lundberg et al., 2012).
CONCLUSIONS
Ces simples recommandations, fondées sur nos connaissances actuelles sur la réaction moléculaire à l'exercice, devraient permettre d'avoir la réaction adaptative maximale à la fois à l'exercice d'endurance et de force. Cependant, améliorer à la fois l'endurance et la force chez un athlète d'élite ne se réduit pas à trouver le bon équilibre entre l'AMPK et la mTOR. C'est particulièrement vrai dans les situations où la performance est fondée sur l'optimisation des compétences qui dépassent largement ces simples voies moléculaires. En fin, la performance d'un athlète dans l'amélioration de son endurance et de sa force dépend de processus beaucoup plus complexes, sur lesquels nous n'avons malheureusement que peu de connaissances.
REFERENCES
Apró, W., L. Wang, M. Ponten, E. Blomstrand, and K. Sahlin (2013). Resistance exercise induced mTORC1 signaling is not impaired by subsequent endurance exercise in human skeletal muscle. Am. J. Physiol. 305:E22-E32.
Baar, K (2013). New ideas about nutrition and the adaptation to endurance training. Sports Science Exchange. 115:1-5.
Baar, K (2014). Nutrition and the molecular response to strength training. Sports Science Exchange. 123:1-4.
Baar, K., and K. Esser (1999). Phosphorylation of p70(S6K) correlates with increased skeletal muscle mass following resistance exercise. Am. J. Physiol. 276:C120-C127.
Coffey, V.G., B. Jemiolo, J. Edge, A.P. Garnham, S.W. Trappe, and J.A. Hawley. (2009a). Effect of consecutive repeated sprint and resistance exercise bouts on acute adaptive responses in human skeletal muscle. Am. J. Physiol. 297:R1441-R1451.
Coffey, V.G., H. Pilegaard, A.P. Garnham, B.J. O'Brien, and J.A. Hawley (2009b). Consecutive bouts of diverse contractile activity alter acute responses in human skeletal muscle. J. Appl. Physiol. 106:1187-1197.
Drummond, M.J., C.S. Fry, E.L. Glynn, H.C. Dreyer, S. Dhanani, K.L. Timmerman, E. Volpi, and B.B. Rasmussen (2009). Rapamycin administration in humans blocks the contraction-induced increase in skeletal muscle protein synthesis. J. Physiol. 587:1535-1546.
Goodman, C.A., J. W. Frey, D.M. Mabrey, B.L. Jacobs, H.C. Lincoln, J.S. You, and T.A. Hornberger (2011). The role of skeletal muscle mTOR in the regulation of mechanical load-induced growth. J. Physiol. 589:5485-5501.
Gwinn, D.M., D.B. Shackelford, D.F. Egan, M.M. Mihaylova, A. Mery, D.S. Vasquez, B.E. Turk, and R.J. Shaw (2008). AMPK phosphorylation of raptor mediates a metabolic checkpoint. Mol. Cell. 30:214-226.
Hickson, R.C. (1980). Interference of strength development by simultaneously training for strength and endurance. Eur. J. Appl. Physiol. Occup. Physiol. 45:255-263.
Inoki, K., T. Zhu, K.L. Guan, (2003). TSC2 mediates cellular energy response to control cell growth and survival. Cell 115:577-590.
Kim, S.G., G.R. Hoffman, G. Poulogiannis, G.R. Buel, Y.J. Jang, K.W. Lee, B.Y. Kim, R.L. Erikson, L.C. Cantley, A.Y. Choo, and J. Blenis (2013). Metabolic stress controls mTORC1 lysosomal localization and dimerization by regulating the TTT-RUVBL1/2 complex. Mol. Cell.49:172-185.
Kraemer, W.J., J.F. Patton, S.E. Gordon, E.A. Harman, M.R. Deschenes, K. Reynolds, R.U. Newton, N.T. Triplett NT, and J.E. Dziados. (1995). Compatibility of high-intensity strength and endurance training on hormonal and skeletal muscle adaptations. J. Appl. Physiol. 78:976-989.
Lundberg, T.R., R. Fernandez-Gonzalo, T. Gustafsson, and P.A. Tesch (2012). Aerobic exercise alters skeletal muscle molecular responses to resistance exercise. Med. Sci. Sports Exerc.44:1680-1688.
McBride, A., S. Ghilagaber, A. Nikolaev,and D.G. Hardie (2009). The glycogen-binding domain on the AMPK beta subunit allows the kinase to act as a glycogen sensor. Cell Metab. 9:23-34.
McCarthy, J.P., J.C. Agre, B.K. Graf, M.A. Pozniak, and A.C. Vailas (1995). Compatibility of adaptive responses with combining strength and endurance training. Med Sci. Sports Exerc.27:429-436.
McCarthy, J.P., M.A. Pozniak, and J.C. Agre (2002). Neuromuscular adaptations to concurrent strength and endurance training. Med. Sci. Sports Exerc. 34:511-519.
Mettler, S., N. Mitchell, and K.D. Tipton (2010). Increased protein intake reduces lean body mass loss during weight loss in athletes. Med. Sci. Sports Exerc. 42:326-337.
Res, P.T., B. Groen, B. Pennings, M. Beelen, G.A. Wallis, A. P. Gijsen, J.M. Senden, and L.J. van Loon. (2012). Protein Ingestion Prior To Sleep Improves Post-Exercise Overnight Recovery.Med. Sci. Sports Exerc. 44:1560-1569.
Roberts, T.J., R. Kram, P.G. Weyand, and C.R. Taylor (1998). Energetics of bipedal running. I. Metabolic cost of generating force. J. Exp. Biol. 201:2745-2751.
Schenk, S., C.E. McCurdy, A. M.Z. Phi Chen, M.J. Holliday, G.K. Bandyopadhyay, O. Osborn, K. Baar, and J.M. Olefsky (2011). Sirt1 enhances skeletal muscle insulin sensitivity in mice during caloric restriction. J. Clin. Invest. 121:4281-4288.
Terzis, G., G. Georgiadis, G. Stratakos, I. Vogiatzis, S. Kavouras, P. Manta, H. Mascher, and E. Blomstrand (2008). Resistance exercise-induced increase in muscle mass correlates with p70S6 kinase phosphorylation in human subjects. Eur. J. Appl. Physiol. 102:145-152.
Thomson, D.M., and S.E. Gordon (2005). Diminished overload-induced hypertrophy in aged fast-twitch skeletal muscle is associated with AMPK hyperphosphorylation. J. Appl. Physiol.98:557-564.
Thomson, D.M., C.A. Fick, and S.E. Gordon (2008). AMPK activation attenuates S6K1, 4E-BP1, and eEF2 signaling responses to high-frequency electrically stimulated skeletal muscle contractions. J. Appl. Physiol. 104:625-632.
Wang, L., H. Mascher, N. Psilander, E. Blomstrand, and K. Sahlin (2011). Resistance exercise enhances the molecular signaling of mitochondrial biogenesis induced by endurance exercise in human skeletal muscle. J. Appl. Physiol. 111:1335-1344.
Wilson, J.M., P.J. Marin, M.R. Rhea, S.M. Wilson J.P. Loenneke, and J.C. Anderson (2012). Concurrent training: a meta-analysis examining interference of aerobic and resistance exercises. J. Strength Cond. Res. 26:2293-2307.
Wojtaszewski, J.F., P. Nielsen, B.F. Hansen, E.A. Richter, and B Kiens (2000) Isoform-specific and exercise intensity-dependent activation of 5'-AMP-activated protein kinase in human skeletal muscle. J. Physiol. 528:221-226.