POINTS PRINCIPAUX
-
Les blessures aux tissus mous du système musculosquelettique sont les blessures les plus fréquentes chez les joueurs de football et représentent environ 70 % de toutes les consultations en physiothérapie.
-
L’une des raisons de ce taux élevé de blessures est que la force, la puissance et la vitesse dépendent de la rigidité des tissus conjonctifs et, par conséquent, les blessures aux muscles qui s’y rattachent sont plus nombreuses.
-
La rigidité des tissus conjonctifs, comme un tendon ou un ligament, dépend de leur contenu en collagène et de la quantité de liaisons entre les molécules de collagène.
-
De telles liaisons augmentent quand les athlètes s’entraînent à courir à grande vitesse ou à changer rapidement de direction.
-
Il est possible de diminuer le nombre de liaisons en effectuant des mouvements lents, ce qui brise les chaînes et les liaisons de collagène.
-
Les cellules des tissus conjonctifs s’adaptent rapidement à l’exercice, se mettent en veilleuse après 5 à 10 minutes d’activité et y réagissent à nouveau après 6 heures complètes.
-
La gélatine et la vitamine C peuvent augmenter la production de collagène, en particulier après la rupture d’un tendon ou d’un ligament.
-
En comprenant : a) la chronologie de l’activation des tissus conjonctifs, b) la période de repos requise et c) le rôle de la nutrition pour améliorer la production de collagène, il est possible d’élaborer un programme d’entraînement et de nutrition permettant de tirer le meilleur parti possible des fonctions des tissus conjonctifs et de réduire le nombre de blessures aux tissus mous.
INTRODUCTION AUX BLESSURES DES TISSUS MOUS
Les blessures aux tissus mous musculosquelettiques (entorses et foulures) sont les blessures les plus fréquentes chez les athlètes. Dans le cas du football, presque 70 % de toutes les blessures sont des entorses ou des foulures (Feeley et coll., 2008). Ce n’est pas une simple question de jeu intermittent ou de contacts violents associés au football, puisque plus de 60 % de toutes les blessures de la Premier League anglaise se rangent également dans cette catégorie (Hawkins et coll., 2001). Si les blessures musculosquelettiques sont extrêmement fréquentes au niveau élite, les tentatives pour comprendre le problème sont très rares et, par conséquent, les progrès en prévention et pour le traitement de ces blessures sont lents. Toutefois, en cas de partie manquée en raison de blessures, les coûts sur le plan de la compétition et sur le plan financier étant considérables, le problème retient de plus en plus l’attention.
L’une des raisons pour lesquelles les blessures musculosquelettiques sont si fréquentes au niveau élite est que, pour être plus performants, les athlètes doivent maximiser la raideur du système musculosquelettique. Chez les athlètes d’endurance, cette raideur est directement liée à l’économie de mouvements (Jones, 2002). Il en est de même pour les athlètes de puissance, comme les joueurs de football, puisque la vitesse de pointe est directement liée à la rigidité des jambes (Chelly & Denis, 2001). Par conséquent, plus grande est la rigidité musculosquelettique, meilleure est la performance. Cependant, à mesure que la rigidité passive augmente, les blessures musculaires induites par l’exercice augmentent aussi (McHugh et coll., 1999). Pour l’essentiel, quand la fermeté du tendon est supérieure à la force du muscle, l’effet protecteur du tendon est perdu et le muscle se rompt.
Le premier objectif du présent article de Sports Science Exchange est d’aider à comprendre comment le système musculosquelettique fonctionne et la raison pour laquelle des blessures surviennent quand il y a un défaut dans ce système. Le deuxième objectif est de présenter certaines données sur les types d’activité et les principes nutritionnels qui permettent de prévenir les blessures aux tissus mous ou d’aider les athlètes à retourner plus rapidement au jeu.
ANATOMIE ET MÉCANISMES ESSENTIELS DES TISSUS MOUS MUSCULOSQUELETTIQUES
Quand ils fonctionnent correctement, les muscles et les tendons forment une seule unité qui transmet aux os la force produite par le muscle en produisant des lésions négligeables. Pour bien fonctionner, ce système a besoin que les protéines contractiles intègrent le muscle, l’appareil intramusculaire transmettant la force, les tissus conjonctifs intramusculaires et les tendons. Chacun de ces systèmes distincts joue un rôle essentiel dans le développement de la force et de la puissance musculaire, ainsi que dans la santé du muscle.
Le muscle produit de la force quand les protéines contractiles (myosine et actine) parcourent un cycle qui dépend d’un apport énergétique (Huxley, 1967). Si la myosine et l’actine sont les principales protéines en cause, d’autres sont aussi nécessaires pour maintenir la structure du muscle en place (Figure 1). En effet, d’autres protéines, comme que la titine, la nébuline α-actinine, la desmine, la protéine musculaire LIM (muscle LIM protein ou MLP) et la protéine musculaire à répétition ankyrine (muscle ankyrin repeat protein ou MARP) jouent toutes un rôle pour s’assurer que la myosine et l’actine sont bien positionnées. Elles contribuent aussi à ce que toute la force produite soit transmise sur toute la longueur du muscle et sur les côtés de la fibre musculaire. Comme nous pouvons nous y attendre, l’expression de ces protéines (surtout MARP et MLP) augmente avec les exercices contre résistance pour permettre un meilleur transfert de la force (Barash et coll., 2002, 2004; Woolstenhulme et coll., 2006).

Si la plupart des gens pensent que le muscle développe sa force par un raccourcissement séquentiel des sarcomères, autrement dit que la force se transmet de façon longitudinale, en réalité, plus de 80 % de la force développée dans la fibre musculaire sont transmis latéralement aux tissus conjonctifs extracellulaires (Ramaswamy et coll., 2011). La transmission latérale a deux grandes fonctions : 1) transmettre la force hors de la fibre sollicitée pour que cette dernière puisse continuer à se raccourcir et 2) relier les fibres adjacentes afin de les protéger des blessures. Ces deux fonctions rendent la transmission latérale essentielle à la performance, puisque c’est ce qui détermine la force et la puissance d’un muscle, et le risque de blessure.
La dystrophine est la mieux caractérisée des protéines qui transmettent la force latérale; elle est bien connue, parce que sa mutation ou son absence chez de jeunes garçons est cause de dystrophie musculaire, une maladie caractérisée par des cycles répétitifs de blessures et de réparation du muscle squelettique. Sans dystrophine, les fibres perdent l’une des principales protéines qui les relient entre elles et qui transmettent la force latéralement (Ramaswamy et coll., 2011). Par conséquent, en l’absence de dystrophine, les fibres fonctionnent de façon indépendante et leur fusion ouvre des trous dans la membrane cellulaire, ce qui permet au calcium de pénétrer et de provoquer la dégénérescence de la fibre (Clafin & Brooks, 2008). Si la dystrophine reste essentielle à la transmission de la force dans un jeune muscle en santé, les taux de dystrophine ne changent pas avec l’entraînement (Parcell et coll., 2009; Woolstenhulme et coll., 2006). Cependant, en l’absence de dystrophine, le taux de l’autre complexe protéique majeur permettant la transmission de la force, l’intégrine α/β, augmente pour essayer de compenser (Liu et coll., 2012). Comme la dystrophine, l’intégrine relie le cytosquelette d’actine à l’intérieur de la fibre au tissu conjonctif externe, permettant la transmission de la force et réduisant les lésions aux muscles (Boppart et coll., 2006). Contrairement à ce qui se passe avec la dystrophine, ce lien mécanique augmente après un exercice contre résistance (Ogasawara et coll., 2014), améliorant la transmission de la force et rendant plus difficiles les blessures à chacune des fibres.
Une fois la force transmise latéralement hors du muscle, elle passe au tissu conjonctif intramusculaire. Comme d’autres tissus conjonctifs, le tissu conjonctif intramusculaire se compose largement de collagène fibrillaire, d’élastine et de substance fondamentale (Jarvinen et coll., 2002). La substance fondamentale est le nom donné aux glycoprotéines qui transmettent l’eau aux tissus et les lubrifient. La protéine la plus abondante dans le tissu conjonctif est le collagène, notamment le collagène de type I. Dans l’organisme, le collagène est l’armature mécanique des tissus conjonctifs intramusculaires, des tendons et des ligaments. La force et la rigidité des tissus conjonctifs et des tendons dépendent donc en partie de la quantité de collagène qu’ils contiennent. Cependant, les longues et fines molécules de collagène ne pourraient pas transmettre la force sans les liaisons chimiques qui les relient (Marturano et coll., 2014). Par conséquent, les liaisons entre les molécules de collagène sont nécessaires à la rigidité des tissus conjonctifs pour qu’ils transmettent efficacement la force musculaire (Marturano et coll., 2014; Reddy et coll., 2002). En général, il y a deux sortes de liaisons : enzymatique et non enzymatique. Les liaisons enzymatiques sont pour la plupart générées par la lysyl oxydase, une enzyme dépendante du cuivre qui lie les résidus lysine des fibres de collagène adjacentes (Kagan et Li, 2003). Les produits des liaisons non enzymatiques sont aussi appelés produits terminaux de glycation avancée (PTG), puisque ces liaisons se forment quand les molécules de sucre lient deux molécules de collagène entre elles. Comme les sucres sont nécessaires à la formation de ces liaisons, les PTG sont beaucoup plus abondants chez les diabétiques (Vlassara et Striker, 2013) et un taux de PTG plus élevé entraîne une plus grande rigidité (Reddy et coll., 2002). Par conséquent, en pratique, les diabétiques sont davantage prédisposés aux blessures musculosquelettiques que d’autres (Ilan et coll., 2003).
À l’extrémité de chaque muscle, le tissu conjonctif intramusculaire et les derniers sarcomères du muscle se joignent pour former la jonction musculotendineuse (jonction entre le muscle et le tendon) (Figure 2). Cette structure est l’une des plus importantes pour déterminer la santé du muscle. Les principales composantes de la jonction musculotendineuse qui protègent le muscle contre les blessures sont les invaginations et l’orientation. L’interface entre le muscle et le tendon n’est pas lisse et plane. Il s’y trouve plutôt des invaginations semblables à des doigts (Polican Ciena et coll., 2012). Ces invaginations ont deux importantes fonctions et sont responsables de la fermeté du tissu. D’abord, ces invaginations augmentent la surface de jonction entre le muscle et le tendon. Ensuite, ces invaginations permettent à l’interface de supporter une contrainte en cisaillement et non en tension. Pour expliquer la différence, imaginons une pièce de Velcro®. La force du Velcro® augmente avec le nombre de boucles et d’attaches (la surface de la zone de jonction), et il est presque impossible de faire glisser des bandes Velcro® l’une contre l’autre (contrainte en cisaillement). À la place, en tirant sur les deux bandes de façon à les éloigner l’une de l’autre (contrainte en tension), la jonction s’affaiblit et elles se séparent. Il en est de même avec la jonction musculotendineuse. La deuxième importante composante de la jonction musculotendineuse est son orientation.
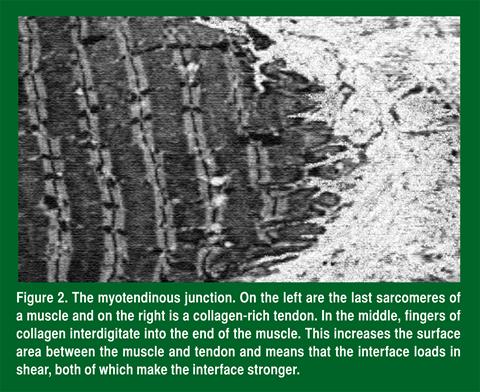
Une fois que la force du muscle atteint un tendon en santé, le tendon transmet à l’os la force exercée par le muscle. Comme le muscle et l’os ont des propriétés mécaniques très différentes (le premier est flexible et le second est rigide), cette simple fonction (transmission de la force) est en fait assez complexe. Pour que la force du muscle flexible se transmette à l’os rigide sans qu’il y ait blessure, le tendon doit agir comme un tissu mécanique variable (Figure 3A). Autrement dit, le tendon est souple près du muscle et devient de plus en plus rigide sur sa longueur jusqu’à ce qu’il arrive près de l’os (Arruda et coll., 2006), ce qui est obtenu en faisant varier l’orientation et les liaisons de collagène dans le tendon. Comme nous l’avons indiqué ci-dessus, l’orientation du collagène change rapidement à la jonction musculotendineuse. Quand le collagène n’est pas bien aligné, il est moins rigide parce qu’il doit d’abord s’aligner et, ensuite, résister à la contrainte. Une fois qu’il est aligné, sa rigidité augmente rapidement. Imaginons à une corde effilochée. Chacune des fibres de la partie effilochée a seulement une fraction de la rigidité de la partie tressée, surtout parce ces fibres sont toutes orientées dans des directions différentes. La deuxième raison pour laquelle les tendons sont plus rigides près du muscle est que, dans cette région, les liaisons y sont plus nombreuses (Curwin et coll., 1994). Comme nous l’avons indiqué ci-dessus, ces liaisons augmentent la rigidité et, comme il y a davantage de liaisons près de l’os que près du muscle, la rigidité augmente à mesure qu’on s’éloigne du muscle et qu’on approche de l’os (Arruda et coll. 2006). Chose intéressante, quand une articulation reste inactive (comme dans un plâtre), les tendons qui se croisent dans cette articulation perdent leur flexibilité (Figure 3B) et deviennent plus rigides (Arruda et coll., 2006), probablement parce que le nombre des liaisons augmente.
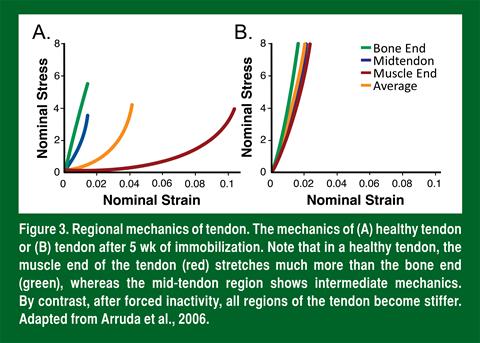
La plus grande rigidité du tendon explique pourquoi les athlètes ont souvent des blessures musculaires s’ils retournent trop rapidement au jeu après une immobilisation.
Dans ce qui précède, les plus importantes notions à retenir sont les suivantes : 1) pour plus de performance, les tendons doivent être rigides, mais cette rigidité augmente le risque de blessure 2) la transmission latérale de la force protège chacune des fibres musculaires contre les blessures en les liant les unes aux autres 3) la région flexible du tendon agit comme un amortisseur et protège tout le muscle contre les blessures. Une autre importante question est : comment la flexibilité du tendon est-elle générée?
ACTIVITÉ CELLULAIRE ET MÉCANIQUE DU TENDON
Comme nous l’avons indiqué ci-dessus, les tendons contiennent de l’eau grâce à leur teneur en substance fondamentale. De fait, plus de 60 % de la masse du tendon est constituée d’eau, ce qui a d’importantes répercussions mécaniques sur les tissus. Ensemble, les liaisons de collagène et l’eau donnent des propriétés mécaniques viscoélastiques aux tendons, qui se comportent à la fois comme un liquide et comme un solide élastique. Pour un athlète, cela signifie que plus rapidement le tendon est soumis à la contrainte, plus il devient rigide et plus il peut emmagasiner d’énergie (Figure 4). Pour comprendre ce concept, imaginons que vous êtes à la piscine. Si vous êtes dans la partie peu profonde, les mains au fond, et que vous vous enfoncez lentement dans l’eau, vous sentez à peine la transition entre l’air et l’eau. C’est que, quand vous bougez lentement, l’eau agit davantage comme des molécules distinctes à travers lesquelles il est facile de se déplacer. Par contre, si vous courez et sautez dans la piscine en tombant sur le ventre, l’eau agit davantage comme une couche de molécules interconnectées et semble beaucoup plus rigide; vous sentez beaucoup plus l’entrée dans l’eau et vous en ressortez le ventre rouge. Si vous montez sur le tremplin de 3 mètres, sautez dans la piscine en tombant sur le ventre, l’eau semble beaucoup plus rigide et vous avez de la chance si vous ne vous retrouvez pas à l’hôpital. Par analogie, si la vitesse est peu élevée, les tendons fonctionnent davantage comme des fibrilles de collagène distinctes, tandis qu’à grande vitesse, ils se comportent davantage comme un seul bloc. Il s’agit là d’une façon d’expliquer comment la mécanique du tendon est générée graduellement et pourquoi elle est perdue en cas d’inactivité.
Pendant les mouvements lents, les molécules de collagène du tendon agissent de façon plus indépendante. À la jonction musculotendineuse (là où le collagène s’invagine avec le muscle) (Figure 2), le collagène près du muscle est tiré différemment de son voisin, d’où une force de cisaillement qui rompt probablement les liaisons entre les molécules de collagène adjacentes. À mesure que le tendon approche de l’os, le collagène est mieux aligné et la contrainte due au cisaillement cesse. Ainsi, les mouvements rapides brisent les liaisons près du muscle, ce qui enlève de la rigidité au tendon dans cette région. Si c’est vraiment le cas, alors une immobilisation du muscle devrait prévenir la rupture des liaisons et, par voie de conséquence, raidir l’extrémité du tendon près du muscle, exactement comme le montre la Figure 3. Dans ces conditions, l’extrémité du tendon devient flexible quand les forces de cisaillement brisent les liaisons entre les molécules de collagène. C’est pourquoi prolonger lentement les contractions est la façon la plus efficace de traiter les tendinopathies (Kingma et coll., 2007).

Déplacer lentement un poids lourd cause plus de cisaillement et de ruptures dans les liaisons, ce qui a pour effet de restaurer la flexibilité du tendon.
Contrairement à ce qui se passe avec les exercices effectués lentement, en cas de mouvements rapides, les molécules de collagène dans le tendon se comportent davantage comme un seul bloc. Par conséquent, chacun des doigts de collagène qui s’invaginent dans le muscle est plus raide, moins flexible, génère moins de contraintes de cisaillement et brise moins les liaisons. Dans le cas du football, sport au cours duquel les joueurs accélèrent, décélèrent et se heurtent constamment, ces types de mouvements balistiques qui augmentent la rigidité des tendons sont les plus courants. C’est peut-être pour cette raison que les massages et le palper-rouler sont appréciés de ces athlètes, car le massage peut réduire une rigidité passive (Huang et coll., 2010). Il reste toutefois qu’incorporer des mouvements lents au programme d’entraînement peut être plus bénéfique à long terme.
Peu importe le type de contrainte (rapide ou lente) subie par le tendon, l’expression de la lysyl oxydase (l’enzyme qui crée de nouvelles liaisons) augmente plus de 20 fois (Heinemeier et coll., 2007). Résultat : en cas de mouvements lents, les liaisons se brisent et se reforment, ce qui conserve au tendon presque toute sa rigidité, tandis que les mouvements rapides créent de nouvelles liaisons qui s’ajoutent à celles qui existent déjà dans les tissus, ce qui rend le tendon de plus en plus rigide. C’est pourquoi les mouvements balistiques à haute vitesse sont ce qu’il y a de mieux pour développer de la puissance (Foure et coll., 2012, 2013).
ENTRAÎNEMENT POUR AMÉLIORER LA FONCTION DES TISSUS MOUS
Pendant des années, les scientifiques, les entraîneurs et les athlètes ont considéré les tendons et les ligaments comme des bandes mécaniques qui ne réagissaient pas à l’exercice. Aujourd’hui, il est clair que ces tissus réagissent à la contrainte. Par exemple, le tendon patellaire de la jambe avant des escrimeurs et des joueurs de badminton est 20 à 30 % plus gros que celui de la jambe arrière (Couppe et coll., 2008). Que partie centrale du collagène d’un tendon ne change pas entre l’âge de 17 ans et de 70 ans (Heinemeier et coll., 2013) permet de penser que le tendon croît comme un arbre, par ajout d’anneaux successifs de collagène qui solidifient sa structure et le rendent plus résistant aux blessures.
Comme nous pouvons ajouter du collagène aux tissus conjonctifs, pour être performant, il est essentiel de comprendre quels types d’exercices sont nécessaires pour augmenter la synthèse du collagène et améliorer la rigidité des tissus conjonctifs. Les cellules des tendons, des ligaments et du tissu conjonctif intramusculaire ne réagissent pas à l’exercice de la même façon que les muscles. Contrairement au muscle qui continue de s’y adapter tant qu’il est actif (Baar, 2009), les cellules du tissu conjonctif agissent davantage comme celles des os et se mettent rapidement en veilleuse après le début d’un exercice (Paxton et coll., 2012). Dans les 10 minutes qui suivent le début d’une activité, les cellules des tissus conjonctifs commencent à se mettre en veilleuse et il a été montré qu’il leur faut 6 h complètes pour réagir à nouveau à l’exercice (Paxton et coll., 2012). Résultat : comme l’os (Burr et coll., 2002), les tendons fabriquent davantage de collagène et deviennent plus résistants quand ils sont étirés de façon intermittente; 10 minutes d’exercice, 6 heures de pause, 10 minutes d’exercice, et ainsi de suite (Paxton et coll., 2012). Autre chose intéressante au sujet des cellules de tissu conjonctif, c’est que ni l’importance (Heinemeier et coll., 2007), ni la fréquence (course vs marche) de la contrainte n’ont d’importance (Paxton et coll., 2012). Par conséquent, même des exercices avec faible amplitude de mouvements et un poids très léger sont efficaces pour augmenter la synthèse de collagène et la fonction des tissus conjonctifs. Pour prévenir les blessures et accélérer le retour au jeu après une blessure, cette information est utile : plusieurs courtes périodes d’activités exerçant une contrainte sur les tissus conjonctifs, chacune étant suivie d’une période de repos, semblent être ce qu’il y a de mieux pour les tissus conjonctifs.
INTERVENTIONS NUTRITIONNELLES POUR AMÉLIORER LA FONCTION DES TISSUS MOUS
Contrairement à la science des muscles, la science des interventions nutritionnelles pouvant améliorer la fonction des tissus mous n’en est qu’à ses balbutiements. Un article a montré que les protéines de lactosérum peuvent améliorer la fonction des tendons (Farup et coll., 2014). Cet article mis à part, il n’y en a pas d’autres pour le moment qui portent sur les effets du régime alimentaire sur les tissus mous chez l’humain. Cependant, à l’aide du modèle d’un ligament mis au point par génie tissulaire, il a été montré que certains acides aminés et la vitamine C peuvent améliorer la synthèse du collagène (Paxton et coll., 2010). Les acides aminés en question, dont la proline, la lysine, l’hydroxylysine et l’hydroxyproline, sont enrichis en gélatine produite à partir des tendons et des ligaments de vache. Certains athlètes prennent désormais de la gélatine et la production en collagène qui en résulte est extrêmement positive; ils retournent dorénavant plus rapidement au jeu après une blessure (Shaw et Baar, données non publiées). Toutefois, des essais cliniques à plus grande échelle sont nécessaires pour bien établir les effets de la gélatine sur la synthèse du collagène dans les tendons.
Même si, à l’heure actuelle, il n’est pas clair que certains nutriments peuvent avoir des effets positifs sur la fonction des tissus mous, la physiologie des tendons et des ligaments donne à penser que les interventions nutritionnelles visant à améliorer la fonction des tissus mous devront être effectuées d’une autre façon que celles qui concernent les muscles. Comme la circulation sanguine dans les tendons et les ligaments est limitée, ces derniers tirent leurs nutriments de tous les liquides absorbés. Dans ce cas-ci, imaginons une éponge essorée et placée dans un liquide. À mesure que l’éponge se gonfle, elle emmagasine du liquide. Il en est de même pour les tissus mous. Lorsqu’ils subissent une contrainte, le liquide en sort et quand ils se relâchent, le liquide du milieu environnant est absorbé. Par conséquent, les nutriments doivent se trouver dans le milieu environnant avant que l’exercice commence afin que la contrainte permette que les tissus mous les absorbent.
RECOMMANDATIONS EN MATIÈRE D’ENTRAÎNEMENT FONDÉES SUR DES DONNÉES SCIENTIFIQUES POUR MAXIMISER LA SANTÉ ET L’EFFICACITÉ DES TISSUS MOUS
Compte tenu de ce qui précède, il est possible d’émettre plusieurs recommandations pour maximiser la performance de l’athlète et minimiser le risque de blessure aux tissus mous.
-
Compte tenu des exercices pliométriques extrêmes que comporte le football, pendant la saison, il faut intégrer des mouvements lents au programme d’entraînement afin de maintenir la flexibilité des tendons et éviter les blessures musculaires.
-
Pour une meilleure prévention des blessures aux tissus mous, il serait approprié d’envisager d’ajouter à l’entraînement une séance consacrée à la santé des tissus conjonctifs. Ce type de séance comporterait 5 à 10 minutes d’une activité ciblant précisément une partie du corps sujette aux blessures. Par exemple, la séance des receveurs éloignés, des demis défensifs, des porteurs de ballon et des secondeurs ciblerait les ischio-jambiers, les quadriceps et les fessiers, tandis que les exercices du quart-arrière cibleraient l’épaule qui lance le ballon. Ces exercices peuvent être effectués avec un poids léger et à l’aide de mouvement d’une amplitude limitée, si nécessaire. Toute séance consacrée à la santé des tissus conjonctifs devrait être effectuée 6 heures avant ou après tout autre entraînement.
-
Des travaux préliminaires suggèrent que 30 à 60 minutes avant une séance consacrée à la santé des tissus conjonctifs et un entraînement, les joueurs doivent être invités à consommer > 2 g de gélatine sous forme de liquide ou de gel.
-
Hors saison, les joueurs peuvent effectuer des mouvements plus rapides au gymnase puisque les contraintes pliométriques hebdomadaires sont nettement moins fréquentes pendant cette partie de l’année. Toutefois, intégrer certains mouvements lents permettra d’améliorer la santé musculosquelettique et mieux stimuler la croissance musculaire.
-
Au début du processus de récupération après une blessure aux tissus mous, les athlètes devraient être invités à effectuer trois courtes séances d’entraînement (de 5 à 10 min) aux 6 h dans une journée. Prendre de la gélatine avant au moins deux de ces séances de récupération peut augmenter la synthèse de collagène dans les tendons, les ligaments, le cartilage et les muscles, et permettre au joueur de retourner plus rapidement au jeu.
RÉFÉRENCES
Arruda, E.M., S. Calve, R,G, Dennis, K. Mundy, and K. Baar (2006). Regional variation of tibialis anterior tendon mechanics is lost following denervation. J. Appl. Physiol. 101:1113-1117.
Baar, K. (2009). The signaling underlying FITness. Appl. Physiol. Nutr. Metab. 34:411-419.
Barash, I.A., D. Peters, J. Friden, G.J. Lutz, and R.L. Lieber (2002). Desmin cytoskeletal modifications after a bout of eccentric exercise in the rat. Am. J. Physiol. 283:R958-R963.
Barash, I.A., L. Mathew, A.F. Ryan AF, J. Chen, and R.L. Lieber (2004). Rapid muscle-specific gene expression changes after a single bout of eccentric contractions in the mouse. Am. J. Physiol. 286:C355-C364.
Boppart, M.D., D.J. Burkin, and S.J. Kaufman (2006). Alpha7beta1-integrin regulates mechanotransduction and prevents skeletal muscle injury. Am. J. Physiol. 290:C1660-C1665.
Burr, D.B., A.G. Robling, and C.H. Turner (2002). Effects of biomechanical stress on bones in animals. Bone 30:781-786.
Chelly, S.M., and C. Denis (2001). Leg power and hopping stiffness: relationship with sprint running performance. Med. Sci. Sports Exerc. 33:326-333.
Claflin, D.R., and S.V. Brooks (2008). Direct observation of failing fibers in muscles of dystrophic mice provides mechanistic insight into muscular dystrophy. Am. J. Physiol. 294:C651-C658.
Couppe, C., M. Kongsgaard, P. Aagaard, P. Hansen, J. Bojsen-Moller, M. Kjaer, and S.P. Magnussen (2008). Habitual loading results in tendon hypertrophy and increased stiffness of the human patellar tendon. J. Appl. Physiol. 105:805-810.
Curwin, S.L., R.R. Roy, and A.C. Vailas (1994). Regional and age variations in growing tendon. J. Morphol. 221:309-320.
Farup, J., S.K. Rahbek, M.H. Vendelbo, A. Matzon, J. Hindhede, A. Bejder, S. Ringgard, and K. Vissing (2014). Whey protein hydrolysate augments tendon and muscle hypertrophy independent of resistance exercise contraction mode. Scand. J. Med. Sci. Sports 24: 788-798.
Feeley, B.T., S. Kennelly, R.P. Barnes, M.S. Muller, B.T. Kelly, S.A. Rodeo, and R.F. Warren (2008). Epidemiology of National Football League training camp injuries from 1998 to 2007. Am. J. Sports Med. 36:1597-1603.
Foure, A., A. Nordez, C. Cornu (2012). Effects of plyometric training on passive stiffness of gastrocnemii muscles and Achilles tendon. Eur. J. Appl. Physiol. 112:2849-2857.
Foure, A., A. Nordez, and C. Cornu (2013). Effects of eccentric training on mechanical properties of the plantar flexor muscle-tendon complex. J. Appl. Physiol. 114:523- 537.
Hawkins, R.D., M.A. Hulse, C. Wilkinson, A Hodson, and M. Gibson (2001). The association football medical research programme: an audit of injuries in professional football. Br. J. Sports Med. 35:43-47.
Heinemeier, K.M., J.L. Olesen, F. Haddad, H. Langberg, M. Kjaer, K.M. Baldwin, and P. Schjerling (2007). Expression of collagen and related growth factors in rat tendon and skeletal muscle in response to specific contraction types. J. Physiol. 582:1303- 1316.
Heinemeier, K.M., P. Schjerling, J. Heinemeier, S.P. Magnusson, and M. Kjaer (2013). Lack of tissue renewal in human adult Achilles tendon is revealed by nuclear bomb 14C. Faseb J. 27:2074-2079.
Huang, S.Y., M. Di Santo, K.P. Wadden KP, D.F. Cappa, T. Alkanani, and D.G. Behm (2010). Short-duration massage at the hamstrings musculotendinous junction induces greater range of motion. J. Strength Cond. Res. 24:1917-1924.
Huxley, H.E. (1967). Recent x-ray diffraction and electron microscope studies of striated muscle. J. Gen. Physiol. 50:Suppl:71-83.
Ilan, D.I., N. Tejwani, M. Keschner, and M. Liebman (2003). Quadriceps tendon rupture. J. Am. Acad. Orthop. Surg. 11:192-200.
Jarvinen, T.A., L. Jozsa, P. Kannus P, T.L. Jarvinen, and M. Jarvinen (2002). Organization and distribution of intramuscular connective tissue in normal and immobilized skeletal muscles. An immunohistochemical, polarization and scanning electron microscopic study. J. Muscle Res. Cell. Motil. 23:245-254.
Jones, A.M. (2002). Running economy is negatively related to sit-and-reach test performance in international-standard distance runners. Int. J. Sports Med. 23:40- 43.
Kagan, H.M., and W. Li (2003). Lysyl oxidase: properties, specificity, and biological roles inside and outside of the cell. J. Cell. Biochem. 88:660-672.
Kingma, J.J., R. de Knikker, H.M. Wittink, and T. Takken (2007). Eccentric overload training in patients with chronic Achilles tendinopathy: a systematic review. Br. J. Sports Med. 41:e3.
Liu, J., D.J. Milner, M.D. Boppart, R.S. Ross, and S.J. Kaufman (2012). Beta1D chain increases alpha7beta1 integrin and laminin and protects against sarcolemmal damage in mdx mice. Hum. Mol. Genet. 21:1592-1603.
Marturano, J.E., J.F. Xylas, and G.V. Sridharan, I. Georgakoudi, and C.K. Kuo (2014). Lysyl oxidase-mediated collagen crosslinks may be assessed as markers of functional properties of tendon tissue formation. Acta Biomater. 10:1370-1379.
McHugh, M.P., D.A. Connolly, R.G. Eston, I.J. Kremenic, S. J. Nicholas, and G.W. Gleim. (1999). The role of passive muscle stiffness in symptoms of exercise-induced muscle damage. Am. J. Sports Med. 27:594-599.
Ogasawara, R., K. Nakazato, K. Sato, M.D. Boppart, and S. Fujita (2014). Resistance exercise increases active MMP and beta1-integrin protein expression in skeletal muscle. Physiol. Rep. 2:e12212.
Parcell, A.C., M.T. Woolstenhulme, and R.D. Sawyer (2009). Structural protein alterations to resistance and endurance cycling exercise training. J. Strength Cond. Res. 23:359-365.
Paxton, J.Z., L.M. Grover, and K. Baar (2010). Engineering an in vitro model of a functional ligament from bone to bone. Tissue Eng. Part A. 16:3515-3525.
Paxton, J.Z., P. Hagerty, J.J. Andrick JJ, and K. Baar (2012). Optimizing an intermittent stretch paradigm using ERK1/2 phosphorylation results in increased collagen synthesis in engineered ligaments. Tissue Eng Part A. 18:277-284.
Polican Ciena, A., S.R. Yokomizo De Almeida, C. De Sousa Bolina, R. De Sousa Bolina- Matos, R.E. Grassi Rici, M.C. Pereira Da Silva, M.A. Miglino, and I.S. Wayanabe (2012). Ultrastructural features of the myotendinous junction of the sternomastoid muscle in Wistar rats: from newborn to aging. Microsc. Res. Tech. 75:1292-1296.
Ramaswamy, K.S., M.L. Palmer, J.H. van der Meulen, A. Renoux, T.Y. Kostrominova, D.E. Michele, and J.A. Faulkner (2011). Lateral transmission of force is impaired in skeletal muscles of dystrophic mice and very old rats. J. Physiol. 589:1195-1208.
Reddy, G.K., L. Stehno-Bittel, and C.S. Enwemeka (2002). Glycation-induced matrix stability in the rabbit achilles tendon. Arch. Biochem. Biophys. 399:174-80.
Shaw, G. and K. Baar (unpublished). Case Study: Nutrition and training to promote recovery in a Rugby player following ACL rupture.
Vlassara, H., and G.E. Striker (2013). Advanced glycation endproducts in diabetes and diabetic complications. Endocrinol. Metab. Clin. North Am. 42:697-719.
Woolstenhulme, M.T., R.K. Conlee, M.J. Drummond, A.W. Stites, and A.C. Parcell (2006). Temporal response of desmin and dystrophin proteins to progressive resistance exercise in human skeletal muscle. J Appl. Physiol. 100:1876-1882.