POINTS PRINCIPAUX
- Contrairement au mode de vie sédentaire, l'exercice modéré régulier réduit le risque d'infection, mais les séances d'exercice très prolongées et les périodes d'entraînement intensif ou de compétition sont associées à une augmentation du risque d'infection. Chez les athlètes, on observe régulièrement que les symptômes de maladie respiratoire apparaissent à l'approche des compétitions, ce qui peut altérer la performance à l'exercice.
- Il a été démontré que les séances prolongées de l'exercice exténuant provoquent une baisse temporaire des fonctions des globules blancs, et il est suggéré que ces changements créent un « créneau » favorable à une baisse de la protection, durant lequel les virus et les bactéries peuvent s'implanter, augmentant ainsi le risque de développer une infection. D'autres facteurs, tels que le stress psychologique, le manque de sommeil et la malnutrition peuvent également altérer l'immunité et provoquer un risque d'infection élevé.
- Les périodes d'entraînement intensif avec une récupération insuffisante peuvent causer un état temporaire d'immunodépression, qui devrait prendre fin avec quelques jours de repos relatif.
- Plusieurs stratégies relatives au comportement, à l'alimentation et à l'entraînement peuvent être adoptées pour limiter l'immunodépression induite par l'exercice et réduire le risque d'infection. Les athlètes peuvent limiter le risque d'infection en évitant d'entrer en contact étroit avec les personnes présentant des symptômes d'infection, en ayant une bonne hygiène au niveau des, de la bouche et de l'alimentation, et en évitant de partager les effets personnels tels que les serviettes et les bouteilles de boissons.
- Pour garder une immunité solide, il est tout aussi important de bien se reposer et de bien dormir que d'éviter les carences en protéines et micronutriments (notamment, le fer, le zinc et les vitamines A, D, E, B6 et B12).
- Il est conseillé aux athlètes d'ingérer des glucides (30 à 60 g [1 à 2 oz] par heure) pendant les séances d'entraînement prolongées et de consommer quotidiennement des suppléments ou des aliments qui contiennent des polyphénols végétaux (flavonoïdes) et des probiotiques Lactobacillus. L'apport supplémentaire en vitamine D3 peut également être souhaitable pour certains athlètes, car la carence en vitamine D est courante en hiver.
INTRODUCTION
L'intensité de l'activité physique effectuée par une personne influe sur son risque d'infection, sans doute en affectant la fonction immunitaire. Il est bien connu que, contrairement au mode de vie sédentaire, l'exercice modéré régulier réduit le risque d'infection (Matthews et al., 2002; Nieman et al., 2011), mais les séances d'exercice très prolongées et les périodes d'entraînement intensif sont associées à une augmentation du risque d'infection. Les séances intensives de l'exercice prolongé et exténuant causent une baisse temporaire de différents aspects de la fonction immunitaire qui dure généralement jusqu'à 24 heures après l'exercice (Walsh et al., 2011b). Plusieurs études indiquent que l'incidence des symptômes d'infection des voies respiratoires supérieures (URS) est réduite dans les jours qui suivent les séances d'endurance exténuantes et prolongées (Gleeson et al., 2013; Walsh et al., 2011b), et il est généralement admis que cela reflète la baisse temporaire de la fonction immunitaire induite par l'exercice prolongé. Les infections peuvent se produire après l'exposition à de nouveaux pathogènes, mais peuvent également être causées par la réactivation d'un virus latent. Mais, plus récemment, il a été proposé qu'au moins certains des épisodes d'URS chez les athlètes sont attribuables à l'inflammation des voies aériennes supérieures, et non aux infections aux pathogènes (Spence et al., 2007). Il a été démontré que les périodes d'entraînement intensif d'une semaine ou plus provoquent une baisse chronique de plusieurs aspects de la fonction immunitaire (Gleeson et al., 2013) et, bien que les athlètes d'élite ne soient pas cliniquement immunodéficients, il est probable que les effets combinés des changements mineurs dans plusieurs facteurs immunitaires puissent compromettre la résistance aux maladies mineures courantes, surtout pendant les périodes d'entraînement intensif et prolongé et lors des compétitions majeures.
EXERCICE, IMMUNITÉ ET MALADIE CHEZ LES ATHLÈTES
Les causes de maladie chez les athlètes
Les maladies les plus courantes chez les athlètes (et la population générale) sont les infections virales des voies respiratoires supérieures (c'est-à-dire le rhume et la grippe), surtout en hiver. Les adultes connaissent généralement entre deux et quatre épisodes de maladie respiratoire par an. Les athlètes peuvent également développer des symptômes similaires (par exemple, la pharyngite) à cause de l'allergie ou de l'inflammation causée par l'inhalation d'air froid, sec ou pollué (Bermon, 2007). Ces symptômes sont généralement bénins, mais que la cause soit une inflammation infectieuse ou allergique, ils peuvent obliger l'athlète à interrompre l'entraînement, à avoir une performance médiocre, voire à manquer une compétition importante. Une récente étude portant sur des centaines d'athlètes d'élite britanniques dans 30 sports différents indique que 33 % des cas d'absence à l'entraînement sont dus à l'infection (le plus souvent des voies respiratoires supérieures). L'analyse des 126 maladies signalées chez les 1 851 athlètes en compétition lors du Championnat du monde d'athlétisme 2011 à Daegu en Corée du Sud révèle que 40 % des maladies affectent les voies respiratoires supérieures, avec une infection confirmée dans près de 20 % des cas (Alonso et al., 2012). Les autres causes de maladie principales concernent la déshydratation induite par l'exercice (12 % des cas) et la gastroentérite/diarrhée (10 % des cas). Des études similaires sur les athlètes en compétition lors des événements majeurs de 2 à 3 semaines indiquent qu'environ 7 % des athlètes enregistrés souffrent généralement d'un épisode de maladie (Alonso et al., 2010; Engebretsen et al., 2010, 2013). Il est intéressant de noter que toutes ces études indiquent que l'incidence de la maladie est supérieure chez les athlètes féminines par comparaison avec leurs collègues masculins.
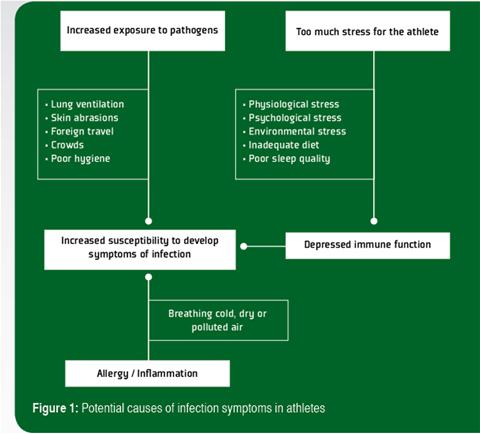
Il a été démontré que les séances prolongées de l'exercice exténuant provoquent une baisse temporaire des fonctions des globules blancs (leucocytes), et il est suggéré que ces changements créent un « créneau » favorable à une baisse de la protection, durant lequel les virus et les bactéries peuvent s'implanter, augmentant ainsi le risque de développer une infection (Walsh et al., 2011b). D'autres facteurs, tels que le stress psychologique, le manque de sommeil et l'alimentation inadéquate (surtout les carences en protéines et micronutriments essentiels) peut également réduire l'immunité (Walsh et al., 2011a) augmenter le risque d'infection. Dans certaines situations, l'exposition de l'athlète aux agents infectieux peut être augmentée, ce qui représente l'autre facteur important déterminant le risque d'infection. Pendant l'exercice, l'exposition des poumons aux bactéries et virus en suspension augmente à cause de la fréquence et de la profondeur accrues de la respiration. L'allergie et l'inflammation des voies aériennes causées par la respiration d'un aide froid, sec ou pollué sont une autre cause de l'URS qui peut être prise par erreur pour une infection respiratoire chez les athlètes. Une augmentation de la perméabilité de l'intestin peut également favoriser l'entrée d'endotoxines bactériennes de l'intestin dans la circulation, surtout pendant l'exercice prolongé par temps chaud. Dans les sports de contact, des abrasions de la peau peuvent se produit, ce qui augmente le risque d'infections transdermiques. Dans certains sports, les concurrents peuvent se trouver à proximité de grandes foules. Le voyage aérien dans les pays étrangers peut jouer un rôle. Il est donc très probable que la cause à l'origine de l'augmentation de l'incidence des symptômes d'infection chez les athlètes soit multifactorielle (Figure 1).
Les effets de l'exercice intensif et prolongé sur la fonction immunitaire
Les séances prolongées d'exercice exténuant ont une incidence temporaire négative sur la fonction immunitaire. La baisse de la fonction immunitaire après l'exercice est plus prononcée lorsque l'exercice est continu, prolongé (>1,5 h), d'une intensité modérée à élevée (55 à 75 % de la capacité aérobique) et effectué sans consommation alimentaire (Gleeson, 2013). De nombreux aspects de l'immunité naturelle, notamment les chimiotactismes neutrophiles, la phagocytose, la dégranulation et l'activité de stimulation oxydative, l'expression de récepteurs de type monocyte (TLR) et l'activité cytotoxique des cellules tueuses naturelles sont réduits par l'exercice prolongé. De même, plusieurs fonctions immunitaires importantes acquises (spécifiques), notamment la présentation de l'antigène par les monocytes/macrophages, la production d'immunoglobuline par les lymphocytes B, la production et la prolifération de cytokine lymphocyte T (par exemple, l'interféron-gamma) sont réduites après l'exercice prolongé. La protection immunitaire muqueuse peut être également compromise : Bien que la réaction de sécrétion salivaire de l'immunoglobuline A (SIgA) à l'exercice intensif soit variable, il est généralement admis que les séances d'exercice très prolongées (par exemple, le marathon) provoquent une baisse de la sécrétion (Walsh et al., 2011b). Les causes de la baisse immunitaire après l'exercice prolongé seraient largement dues aux augmentations dans les hormones du stress en circulation (par exemple, l'épinephrine et le coristol) et aux altérations de l'équilibre de cytokine pro-/anti-inflammatoire (particulièrement les niveaux élevés en circulation de l'antagoniste du récepteur de l'interleukine (IL)-6, IL-10, IL-1 (IL-1ra) et les récepteurs du facteur soluble de nécrose tumorale (TNF)) qui ont des actions inhibitrices sur l'activation immunitaire.
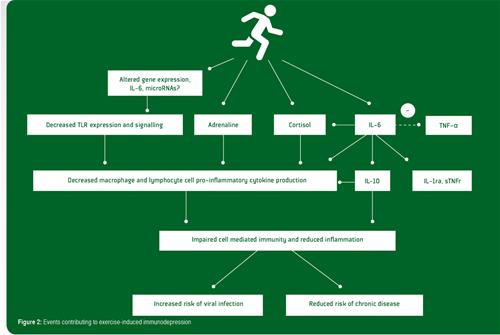
Des études récentes portant sur l'expression des gènes dans les leucocytes après l'exercice prolongé décrivent une augmentation de l'expression de beaucoup de gènes impliqués dans les actions anti-inflammatoires et une régulation baissière des gènes dans la voie de signalisation du récepteur TLR qui provoque la production de cytokine pro-inflammatoire et l'activation immunitaire (Abbassi et al., 2013, 2014). Beaucoup de facteurs et d'hormones induits par l'exercice peuvent être impliqués dans l'organisation de cette réaction générale des gènes anti-inflammatoires. Ces facteurs comprennent les catécholamines, le cortisol, l'hormone de croissance, les protéines de choc thermique et l'IL-6 dérivé des muscles (Gleeson et al., 2011). Le cortisol est connu pour ses nombreuses fonctions immunosuppressives et anti-inflammatoires et joue très probablement un rôle important dans ce contexte. Cependant, il semble prudent de dire que l'IL-6 est vraisemblablement l'acteur clé dans l'orchestration de cette réaction anti-inflammatoire générale. Pendant l'exercice, l'IL-6 est libéré par les fibres musculaires en contraction et provoque la libération de l'IL-10 et de l'IL-1ra, de l'hormone adrénocorticotrophique et du cortisol, ainsi que des réactifs de phase aiguë des hépatocytes (par exemple, l'α1 glycoprotéine acide et la protéine C-réactive). L'induction de la production de l'IL-10 via les augmentations induites par l'exercice de l'IL-6 en circulation peut représenter un événement anti-inflammatoire direct et préemptif plutôt qu'une contre-régulation compensatoire par rapport à un stimulus inflammatoire primaire. Bien que l'IL-6 et ses suiveurs puissent expliquer la plupart des réactions anti-inflammatoires signalées, il est possible que des mécanismes supplémentaires soient à l'œuvre. Par exemple, l'exercice produit une induction rapide des micro-ARN (Tonevitsky et al., 2013) qui sont capables d'interférer avec les TLR, et il a été suggéré qu'un tel mécanisme pourrait également être déterminant pour induire la réaction anti-inflammatoire à l'exercice (Abbasi et al., 2014). Les différents événements qui contribuent à l'immunodépression induite par l'exercice sont résumés dans la Figure 2.
Les effets d'entraînement à l'exercice de longue durée sur la fonction immunitaire
Les indices de la fonction immunitaire chez les athlètes en état de repos complet (c'est-à-dire au moins 24 heures après la dernière séance d'exercice) ne sont généralement pas très différents de ceux des sédentaires, sauf si les athlètes sont engagés dans des périodes d'entraînement intensif. Dans ce cas, la fonction immunitaire pourrait ne pas se remettre complètement des séances d'entraînement successives et certaines fonctions peuvent baisser de façon chronique (Gleeson et al., 2013). Les fonctions des lymphocytes T et B semblent sensibles aux augmentations de la charge d'entraînement chez les athlètes bien entraînés soumis à une période d'entraînement intensif, avec des baisses dans les nombres de cellules T de type 1 en circulation, une inhibition de la production de cytokine des cellules T de type 1, des réactions prolifératives des cellules T et des chutes dans la synthèse d'immunoglobuline stimulée des cellules B et de SIgA. Cependant, à ce jour, la seule variable immunitaire qui a été régulièrement associée à l'augmentation de l'incidence de l'infection est SIgA. Les faibles concentrations de SIgA chez les athlètes ou les chutes temporaires de SIgA sont associées aux risques d'épisodes d'URS (Neville et al., 2008). En revanche, les augmentations des niveaux de SIgA peuvent se produite après une période d'entraînement à l'exercice modéré et régulier chez des personnes qui étaient sédentaires et pourraient, du moins en partie, contribuer à la susceptibilité réduite apparente à l'URS associée à l'exercice modéré régulier (Walsh et al., 2011b). Les athlètes vulnérables à la maladie tendent à avoir un faible taux de sécrétion de SIgA et une production d'IL-10 in vitro élevée dans les cultures de sang entier exposées à un problème d'antigène (Gleeson et Bishop, 2013), ce qui peut affaiblir les défenses immunitaires contre les micro-organismes. Les athlètes ayant un faible niveau de vitamine D, des charges d'entraînement élevées et aucune infection préalable au cytomégalovirus et au virus d'Epstein-Barr semblent plus susceptibles aux épisodes d'URS (He et al., 2013).
La prévention de l'infection est un domaine de recherche important en termes de santé à la fois de la population générale et des athlètes soumis à de longues périodes d'entraînement intensif. En termes d'incidence négative sur l'entraînement, les périodes répétées d'infection sont comparables aux blessures physiques récurrentes qui peuvent être catastrophiques lorsqu'elles surviennent à l'approche des compétitions majeures. Par conséquent, l'étude effectuée par Neville et al. (2008) est particulièrement encourageante parce qu'en menant une analyse rétrospective des échantillons salivaires de 38 athlètes de la Coupe des Amériques sur 50 semaines, elle montre que lorsque les valeurs SIgA relatives des athlètes tombent de 40 % ou plus, la probabilité qu'ils soient touchés par des infections dans 1 à 2 semaines augmente. Avec la disponibilité imminente des dispositifs portatifs permettant d'effectuer une analyse salivaire rapide « sur le terrain », ces mesures peuvent offrir une méthode efficace pour informer les entraîneurs lorsque les athlètes sont le plus vulnérables aux infections, ce qui permettrait d'éviter les problèmes associés à l'augmentation des charges d'entraînement.
Il est généralement admis que l'exposition au temps froid et humide peut augmenter la probabilité de contracter un rhume, mais les données disponibles n'indiquent pas que les athlètes qui s'entraînent et concourent dans des conditions de froid enregistrent une réduction de la fonction immunitaire par rapport à ceux qui évoluent dans des conditions thermiquement neutres (Walsh et al., 2011b). L'inhalation de l'air froid et sec peut réduire le mouvement ciliaire des voies aériennes supérieures et l'écoulement muqueux, mais il n'est pas clair si les athlètes qui s'entraînent et concourent dans des conditions de froid connaissent des infections plus fréquentes, plus graves ou plus durables. D'autres environnements extrêmes (par exemple, la chaleur et l'altitude) ne semblent pas avoir d'incidence marquée sur la réaction immunitaire à l'exercice (Walsh et al., 2011b).
APPLICATIONS PRATIQUES
Directives pour maintenir la santé immunitaire et limiter le risque d'infection
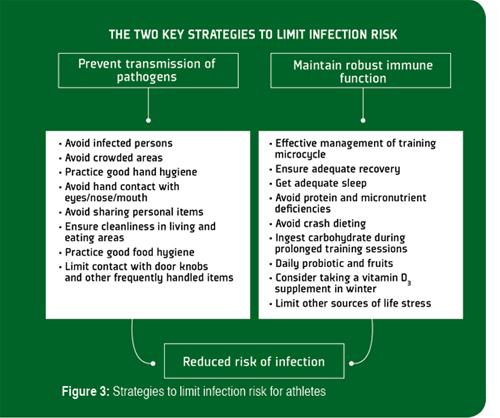
Il est généralement admis que la prévention est toujours préférable au traitement et, bien qu'il n'y ait pas de méthode unique capable d'éliminer complètement le risque de contracter une infection, plusieurs stratégies efficaces en matière de comportement, d'alimentation et d'entraînement (Figure 3) permettent de limiter l'étendue de l'immunodépression induite par l'exercice et de réduire l'exposition aux pathogènes et le risque d'infection (Walsh et al., 2011a).
Limiter la transmission des infections
Les directives les plus importantes pour limiter la transmission des infections parmi les athlètes sont : avoir une bonne hygiène des mains et éviter le contact avec les personnes infectées (Tableau 1). Se laver les mains (en utilisant la technique appropriée afin de s'assurer que toutes les parties des mains sont bien propres) avec de l'eau et du savon est une méthode efficace contre la plupart des pathogènes, mais n'offre pas de protection continue. Les gels antiseptiques qui contiennent >60 % d'alcool offrent une désinfection efficace, mais la protection qu'ils offrent ne dure pas plus de quelques minutes, ils doivent donc être appliqués fréquemment, ce qui risque de dessécher la peau et l'irriter. Parmi les autres méthodes de désinfection, on trouve l'utilisation des solutions mousseuses antimicrobiennes à base de biocides cationiques et de polymères hydrophobiques qui offriraient une désinfection des mains jusqu'à 6 heures. Toutefois, il doit être noté que ces produits sont éliminés lorsqu'on se lave les mains et en cas de sudation excessive et doivent donc être régulièrement réappliqués.


Maintenir une immunité solide et limiter le stress lié à l'entraînement
Pour limiter le risque d'infection, les athlètes peuvent également suivre des directives pratiques qui leur permettent de maintenir une immunité solide et de limiter l'incidence du stress lié à l'entraînement (Tableau 2). Ces directives concernent essentiellement les stratégies d'alimentation, d'entraînement et de récupération, et sont fondées sur les résultats de nombreuses études. Les stratégies d'alimentation les plus efficaces pour maintenir une fonction immunitaire solide pendant l'entraînement intensif consistent à éviter les carences en micronutriments essentiels, à consommer des glucides pendant l'exercice et à ingérer quotidiennement des probiotiques Lactobacillus. Bien que tous les probiotiques n'aident pas à maintenir des niveaux appropriés de SIgA salivaire, l'ingestion prolongée de souches de Lactobacillus a donné des résultats encourageants (Gleeson et al., 2012). Par conséquent, il convient de conseiller les athlètes sur la meilleure façon de fortifier leurs régimes alimentaires avec le type de probiotique approprié. Certaines études suggèrent également que la consommation régulière de fruits et de suppléments (par exemple, la quercétine) ou d'aliments (par exemple, la bière sans alcool et le thé vert) riches en polyphénols végétaux peut réduire la fréquence d'URS. Beaucoup d'autres suppléments alimentaires, notamment le β-glucane, le colostrum, l'échinacée, la glutamine et d'autres stimuleraient le système immunitaire, mais aucune preuve scientifique définitive n'atteste qu'ils empêchent efficacement l'immunodépression induite par l'exercice.
En plus de l'observation des règles d'une bonne hygiène personnelle, la composition du régime alimentaire et le moment de la consommation des aliments peuvent également aider à la protection contre les infections. La fonction immunitaire étant compromise après l'entraînement intensif et la compétition, et que la consommation des glucides, des protéines et des liquides aide à restaurer cette fonction (Costa et al., 2012; Fortes et al., 2012; Witard et al., 2014), il est important que les athlètes soient encouragés à développer des stratégies d'alimentation axées sur la période d'après l'exercice dans le cadre de leurs plans nutritionnels généraux.
RÉSUMÉ
Il existe aujourd'hui des preuves suffisantes pour étayer l'idée que l'exercice prolongé et exténuant est associé à une suppression temporaire des fonctions immunitaires, qui sont généralement récupérées dans les 24 heures. Cependant, dans les situations d'entraînement intensif, le manque de récupération suffisante entre les séances d'exercice peut provoquer une baisse chronique des réponses immunitaires. Il a été suggéré que ces effets sur la défense de l'hôte interviennent dans la fréquence élevée d'URS parmi les athlètes suivant un entraînement intensif, ce qui risque de causer des absences à l'entraînement et une baisse de la performance. Alors qu'il est absolument certain que les épisodes d'URS touchent largement les athlètes, aucune cause infectieuse de ces symptômes n'a jamais été confirmée. Plusieurs stratégies d'entraînement, de comportement et d'alimentation peuvent aider à réduire le risque d'URS et devraient faire partie de la routine de l'athlète.
RÉFÉRENCES
Abbasi, A., E. Fehrenbach, M. Hauth, M. Walter, J. Hudemann, V. Wank, A.M. Niess, and H. Northoff (2013). Changes in spontaneous and LPS-induced ex vivo cytokine production and mRNA expression in male and female athletes following prolong exhaustive exercise. Exerc. Immunol. Rev. 19:8-28.
Abbasi, A., M. Hauth, M. Walter, J. Hudemann, V. Wank, A.M. Niess, and H. Northoff (2014). Exhaustive exercise modifies different gene expression profiles and pathways in LPS-stimulated and un-stimulated whole blood cultures. Brain Behav. Immun. 39:130-141.
Alonso, J.M., P.M. Tscholl, L. Engebretsen, M. Mountjoy, J. Dvorak, and A. Junge (2010). Occurrence of injuries and illnesses during the 2009 IAAF World Athletics Championships. Br. J. Sports Med. 44:1100-1105.
Alonso, J.M., P. Edouard, G. Fischetto, B. Adams, F. Depiesse, and M. Mountjoy (2012). Determination of future prevention strategies in elite track and field: analysis of Daegu 2011 IAAF Championships injuries and illnesses surveillance. Br. J. Sports Med. 46:505-514.
Bermon, S. (2007). Airway inflammation and upper respiratory tract infection in athletes: is there a link? Exerc. Immunol. Rev. 13:6-14.
Costa, R.J., M.B. Fortes, K. Richardson, J.L. Bilzon, and N.P. Walsh (2012). The effects of postexercise feeding on saliva antimicrobial proteins. Int. J. Sport Nutr. Exerc. Metab. 22:184-191.
Engebretsen, L., K. Steffen, J.M. Alonso, M. Aubry, J. Dvorak, A. Junge, W. Meeuwisse, M. Mountjoy, P. Renström, and M. Wilkinson (2010). Sports injuries and illnesses during the Winter Olympic Games 2010. Br. J. Sports Med. 44:772-780.
Engebretsen, L., T. Soligard, K. Steffen, J.M. Alonso, M. Aubry, R. Budgett, J. Dvorak, M. Jegathesan, W.H. Meeuwisse, M. Mountjoy, D. Palmer-Green, I. Vanhegan, and P.A. Renström (2013). Sports injuries and illnesses during the London Summer Olympic Games 2012. Br. J. Sports Med. 47:407-414.
Fortes, M.B., B.C. Diment, U. Di Felice, and N.P. Walsh (2012). Dehydration decreases saliva antimicrobial proteins important for mucosal immunity. Appl. Physiol. Nutr. Metab. 37:850-859.
Gleeson, M., N.C. Bishop, D.J. Stensel, M.R. Lindley, S.S. Mastana, and M.A. Nimmo (2011). The anti-inflammatory effects of exercise: mechanisms and implications for the prevention and treatment of disease. Nat. Rev. Immunol. 11:607-615.
Gleeson, M., J. Siegler, L.M. Burke, S. Stear, and L.M. Castell (2012). A to Z of nutritional supplements: Dietary supplements, sports nutrition foods and ergogenic aids for health and performance – Part 31. (Probiotics). Br. J. Sports Med. 46:377-378.
Gleeson, M. (2013). Exercise, nutrition and immunity. In: P.C. Calder and P. Yaqoob (eds.), Diet, Immunity and Inflammation. Cambridge: Woodhead Publishing, pp. 652-685.
Gleeson, M., and N.C. Bishop (2013). URI in athletes: Are mucosal immunity and cytokine responses key risk factors? Exerc. Sport Sci. Rev. 41:148-153.
Gleeson, M., N.C. Bishop, and N.P. Walsh (eds.) (2013). Exercise Immunology. Abingdon: Routledge.
He, C.-S., M. Handzlik, W.D. Fraser, A. Muhamad, H. Preston, A. Richardson, and M. Gleeson (2013). Influence of vitamin D status on respiratory infection incidence and immune function during 4 months of winter training in endurance sport athletes. Exerc. Immunol. Rev. 19:86-101.
Larson-Meyer D.E., and K.S. Willis (2010). Vitamin D and athletes. Curr. Sports Med. Rep. 9:220-226.
Matthews, C.E., I.S. Ockene, P.S. Freedson, M.C. Rosal, P.A. Merriam, and J.R. Hebert (2002). Moderate to vigorous physical activity and the risk of upper-respiratory tract infection. Med. Sci. Sports Exerc. 34:1242-1248.
Neville, V., M. Gleeson, and J.P. Folland (2008). Salivary IgA as a risk factor for upper respiratory infections in elite professional athletes. Med. Sci. Sports Exerc. 40:1228- 1236.
Nieman, D.C., D.A. Henson, M.D. Austin, and W. Sha (2011). Upper respiratory tract infection is reduced in physically fit and active adults. Br. J. Sports Med. 45:987-992.
Robson-Ansley, P., G. Howatson, J. Tallent, K. Mitcheson, I. Walshe, C. Toms, G. Du Toit, M. Smith, and L. Ansley (2012). Prevalence of allergy and upper respiratory tract symptoms in runners of the London Marathon. Med. Sci. Sports Exerc. 44:999- 1004.
Spence, L., W.J. Brown, D.B. Pyne, M.D. Nissen, T.P. Sloots, J.G. McCormack, A.S. Locke, and P.A. Fricker (2007). Incidence, etiology, and symptomatology of upper respiratory illness in elite athletes. Med. Sci. Sports Exerc. 39:577-586.
Tonevitsky, A.G., D.V. Maltseva, A. Abbasi, T.R. Samatov, D.A. Sakharov, M.U. Shkurnikov, A.E. Lebedev, V.V. Galatenko, A.I. Grigoriev, and H. Northoff (2013). Dynamically regulated miRNA-mRNA networks revealed by exercise. BMC Physiol. 13:9
Walsh. N.P., M. Gleeson, D.B. Pyne, D.C. Nieman, F.S. Dhabhar, R.J. Shephard, S.J. Oliver, S. Bermon, and A. Kajėnienė (2011a). Position Statement Part Two: Maintaining immune health. Exerc. Immunol. Rev. 17:64-103.
Walsh, N.P., M. Gleeson, R.J. Shephard, M. Gleeson, J.A. Woods, N.C.Bishop, M. Fleshner, C. Green, B.K. Pedersen, L. Hoffman-Goetz, C.J. Rogers, H. Northoff, A. Abbasi, and P. Simon (2011b). Position Statement Part One: Immune function and exercise. Exerc. Immunol. Rev. 17:6-63.
Witard, O.C., J.E. Turner, S.R. Jackman, A.K. Kies, A.E. Jeukendrup, J.A. Bosch, and K.D. Tipton (2014). High dietary protein restores overreaching induced impairments in leukocyte trafficking and reduces the incidence of upper respiratory tract infection in elite cyclists. Brain. Behav. Immun. 44:1689-1697.